Поздравляем Елену Владимировну Кравченко и Михаила Павловича Зарубина с получением патента!

Авторы:
Кравченко Елена Владимировна (ЛЯП ОИЯИ),
Зарубин Михаил Павлович (ЛЯП ОИЯИ),
Апель Павел Юрьевич (ЛЯР ОИЯИ),
Нечаев Александр Николаевич (ЛЯР ОИЯИ),
Андреев Евгений Валерьевич (ЛЯР ОИЯИ).
Изобретение относится к мембранам, предназначенным для процессов разделения в области биотехнологии. Фильтрующий пористый материал для селективного выделения и концентрирования внеклеточных нуклеиновых кислот из растворов с поверхностью и множеством пор, которые ковалентно модифицированы неупорядоченным ДНК-РНК связывающим белком тихоходок. В качестве фильтрующего пористого материала применяют полиэтилентерефталатные трековые мембраны. Фильтрующий материал позволяет с высокой эффективностью и селективностью в короткие сроки и без предварительной пробоподготовки выделять и концентрировать короткие и длинные внеклеточные нуклеиновые кислоты при фильтровании биологических жидкостей различного происхождения. 1 з.п. ф-лы, 1 ил., 3 пр.
Изобретение относится к разработке материалов для концентрирования и селективного выделения внеклеточных нуклеиновых кислот из биологических, медицинских, биотехнологических и экологических жидкостей или растворов. Сферами внедрения являются медицина, экологический мониторинг, биотехнологическая и фармацевтическая промышленности, научно-лабораторная и криминалистическая практики.
Проведенный патентный поиск показал отсутствие фильтрующих пористых материалов, аналогичных предлагаемой разработке, для выделения и концентрирования внеклеточных нуклеиновых кислот из растворов и биологических жидкостей.
В патентах US 6746841 B1, «FTA-coated media for use as a molecular diagnostic tool», опубл. 2004.06.08 и WO 2000062023 A1, «FTA-coated media for use as a molecular diagnostic tool background of the invention technical field», опубл. 2000.10.19 для извлечения из растворов нуклеиновых кислот предлагается использование целлюлозных и стеклянных пористых материалов, модифицированных FTA-реагентом (Flander Technology Australia). Недостатком таких материалов является отсутствие возможности фильтрования больших объемов биологических жидкостей и быстрое загрязнение фильтра компонентами жидкостей.
В патенте US 20170211059 A1 «Method and device for collection and amplification of circulating nucleic acids», опубл. 2017.07.27 для фильтрования биологических жидкостей с целью сбора нуклеиновых кислот используются твердые матрицы из целлюлозы и ее производных, кварцевого волокна, гидрофильных полимеров, политетрафторэтилена, стекловолокна и пористой керамики. Ограничением метода является неспецифическое осаждение на матрицу всех компонентов биологической жидкости, не только нуклеиновых кислот, но и белковых и липидно-белковых комплексов, что требует последующей очистки ДНК с помощью стандартных методов, и быстрое загрязнение матрицы, что не позволяет работать с большими объемами биологических жидкостей.
В патенте WO 2019144030 A1 «Method for isolating and purifying nucleic acids using a solid-liquid phase system», опубл. 2019.07.25 (прототип) описывается модифицированный пористый материал с поверхностью и множеством пор, которые содержат множество катионных аминогрупп для извлечения ДНК из растворов. В качестве катионных групп предлагается использовать алифатические амины и полиамины, содержащие до 12 атомов углерода. Недостатком предлагаемого материала для очистки и концентрирования является невозможность связывания РНК и отсутствие связывания средних и коротких молекул ДНК (менее 20 т. п. н.), составляющих основную часть внеклеточных нуклеиновых кислот.
Технической задачей изобретения является создание фильтрующего пористого материала, позволяющего с высокой эффективностью и селективностью в короткие сроки и без предварительной пробоподготовки выделять и концентрировать короткие и длинные внеклеточные нуклеиновые кислоты при фильтровании биологических жидкостей различного происхождения.
Техническим результатом является то, что поверхность и множество пор пористого материала ковалентно модифицированы неупорядоченным ДНК-РНК связывающим белком тихоходок. Как вариант, в качестве фильтрующего пористого материала применяют полиэтилентерефтолатные трековые мембраны.
Описание фигур
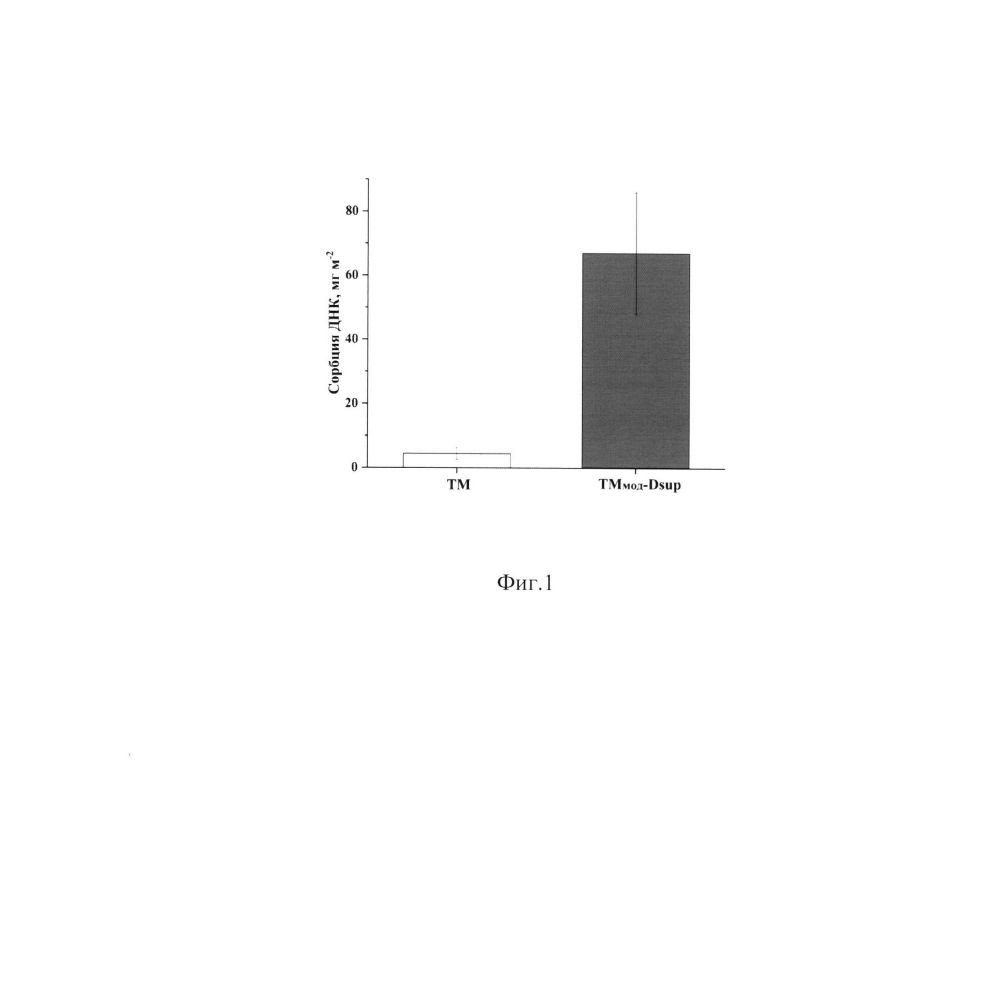
Фиг. 1. Диаграмма показывает сорбцию плазмидной ДНК на ПЭТ трековых мембранах с диаметром пор 4.5 мкм до и после их ковалентной модификации белком тихоходок Dsup.
По оси Y - сорбция ДНК на единицу площади ТМ.
Осуществление изобретения
Для достижения указанного технического результата производится фильтрующий пористый материал с повышенной способностью к селективному связыванию нуклеиновых кислот. В качестве пористой структуры используются, например, полиэтилентерефтолатные трековые мембраны (ТМ) с диаметром пор от 0.1 до 10 мкм. ТМ ковалентно модифицируются неупорядоченным ДНК-РНК связывающим белком тихоходок, например белком Dsup, в ходе стандартного процесса, включающего в себя: (1) водный золь-гель синтез гидроксида алюминия А1(ОН)3 на поверхность ТМ на основе прекурсорной соли AlCl3⋅6H2O, (2) силанизацию ТМ с использованием 1% АПТЕС, (3) обработки ТМ глутаровым альдегидом (ГА) и (4) ковалентное связывание аминогрупп белка Dsup с альдегидными группами глутарового альдегида в ходе фильтрования через ТМ раствора белка Dsup.Сорбция белка контролируется по уменьшению его концентрации в растворе, а также путем контроля морфологии (сканирующая электронная микроскопия) и заряда поверхности ТМ (дзета-потенциометрия). Таким образом, синтезируется материал TM-Al(OH)3-АПТЭС-ГА-Dsup с ковалентно связанным белком Dsup на поверхности ТМ (далее TMмод-Dsup).
Для связывания свободных нуклеиновых кислот из раствора TMмод-Dsup нужного размера помещается в фильтродержатель фильтрующего элемента, например в шприцевой фильтродержатель Swinnex фильтрующего элемента HSW HENKE-JECT, затем через полученную систему фильтруются растворы, содержащие свободные нуклеиновые кислоты, требуемого для анализа объема, например 1 мл, 10 мл, 100 мл, 1 л, 10 л, в зависимости от объема фильтрующего элемента и объема образца. В ходе фильтрации белок Dsup нековалентно связывает нуклеиновые кислоты, которые после окончания фильтрации смываются с TMмод-Dsup мембраны небольшим объемом растворителя, например стандартным 10-кратным фосфатно-солевым буфером, водой, буфером ТЕ, и используются для дальнейшего анализа. Количество связанных мембраной нуклеиновых кислот оценивается по изменению их концентрации в растворе до и после фильтрации.
Пример 1. С помощью модифицированных трековых мембран (TMмод-Dsup) проводилось концентрирование раствора плазмидной ДНК размером 6000 п. н. с содержанием ДНК 0.25 мг/мл и объемом 1 мл. Для этого в шприцевой фильтродержатель Swinnex фильтрующего элемента HSW HENKE-JECT помещалась TMмод-Dsup диаметром 25 мм с размером пор 4.5 мкм. После чего проводилось фильтрование раствора ДНК через TMмод-Dsup.Определение концентрации ДНК в растворе производилось флуориметрическим методом с помощью Qubit dsDNA HS Assay Kit и флуориметра Qubit 4 (Thermo Fisher Scientific). После фильтрации более 70% ДНК из раствора сорбировалось на ТМмод-Dsup, расчетная адсорбционная емкость композита TMмод-Dsup для плазмидной ДНК размером 6000 п. н. составила 70±19 мг/м2. В качестве контроля использовалась исходная немодифицированная белком тихоходок ТМ, где адсорбционная емкость для плазмидной ДНК размером 6000 п. н. составила около 4 мг/м2. Таким образом, путем модификации ТМ белком тихоходок Dsup достигнута высокая степень концентрирования ДНК из раствора и почти 20-кратное увеличение сорбции ДНК на модифицированном пористом материале по сравнению с немодифицированным пористым материалом (Фиг. 1). Десорбция ДНК с поверхности TMмод-Dsup проводилась путем однократного фильтрования 0.22 мл деионизованной воды через мембрану, что позволило смыть 40% ДНК.
Пример 2. С помощью модифицированных трековых мембран (TMмод-Dsup) проводилось концентрирование раствора тотальной РНК, выделенной из Е. coli., с содержанием РНК 0.03 мг/мл и объемом 1 мл. Для этого в шприцевой фильтродержатель Swinnex фильтрующего элемента HSW HENKE-JECT помещалась TMмод-Dsup диаметром 25 мм с размером пор 0.3 мкм. После чего проводилось однократное фильтрование раствора РНК. Измерение содержания РНК в растворах производилось с помощью Qubit RNA High Sensitivity Assay Kit и флуориметра Qubit 4 (Thermo Fisher Scientific). После однократной фильтрации более 30% РНК из раствора сорбировалось на TMмод-Dsup и расчетная адсорбционная емкость композита TMмод-Dsup для тотальной РНК Е. coli. составила 14±1.9 мг/м2. Таким образом, подтверждена возможность использования композитного материала TMMOa-Dsup для концентрирования РНК из растворов.
Пример 3. С помощью TMмод-Dsup проводилось концентрирование раствора одноцепочечной олигонуклеотидной ДНК длиной 20 нуклеотидов с концентрацией 1 мг/мл и объемом 0.5 мл. Для этого в шприцевой фильтродержатель Swinnex фильтрующего элемента HSW HENKE-JECT помещалась TMмод-Dsup диаметром 25 мм с размером пор 0.3 мкм и проводилось пятикратное фильтрование раствора через ТМмод-Dsup.Определение концентрации ДНК в растворе производилось спектрофотометрически с помощью прибора Implen NanoPhotometer NP80. После фильтрации ~22.5% одноцепочечной олигонуклеотидной ДНК из раствора сорбировалось на TMM(Wl-Dsup, расчетная адсорбционная емкость композита TMмод-Dsup для одноцепочечной олигонуклеотидной ДНК длиной 20 нуклеотидов составила 22.9±2.0 мг/м2. Таким образом, показано что полученный композит TMмод-Dsup может сорбировать короткие одноцепоченые фрагменты ДНК.
Как видно из приведенных примеров, предлагаемый материал обеспечивает высокий уровень связывания нуклеиновых кислот из растворов, но при этом не требуя сложной и длительной пробоподготовки биологической жидкости.
Преимуществами полученного материала для концентрирования нуклеиновых кислот, по сравнению с известными, являются:
1. Селективность выделения внеклеточных нуклеиновых кислот из биологических растворов различной природы.
2. Возможность работы с биологическими жидкостями в широком диапазоне объемов растворов и концентраций нуклеиновых кислот.
3. Простота использования материала, что важно, в том числе при работе в полевых условиях, без использования дополнительного специального оборудования (центрифуги, термостаты и т.п.).
4. Возможность встраивания полученного пористого материала в различные уже существующие устройства для фильтрования и масштабирование технологического процесса.
5. Отсутствие разведения образца.
6. Простота выполнения, в том числе возможность использования при работе в полевых условиях, без использования дополнительного специального оборудования (центрифуги, термостаты и т.п.).
7. Низкие временные затраты, связанные только со скоростью фильтрации.
8. Нетоксичность и стабильность полученного гибридного материала.
Формула изобретения
1. Фильтрующий пористый материал для селективного выделения и концентрирования внеклеточных нуклеиновых кислот из растворов с поверхностью и множеством пор, причем указанная поверхность и указанные поры ковалентно модифицированы неупорядоченным ДНК-РНК связывающим белком тихоходок.
2. Фильтрующий пористый материал для селективного выделения и концентрирования внеклеточных нуклеиновых кислот из растворов по п. 1, отличающийся тем, что в качестве пористого материала применяют полиэтилентерефталатные трековые мембраны.
Источник: ФИПС
Подробнее о работе ученых читайте в журнале Biotechnology Progress
Уникальный подход к извлечению ДНК: фундаментальная наука на страже новых технологий!